Вариант 1
1. Из данного перечня веществ
выпишите формулы оксидов:
HBr, Na2SO4, CuO, Fe(OH)2, NO2,
HNO3, NaOH, MgSO4, SO2, H3PO4,
MgO, HCI, LiOH, Ca3(PO4)2, H2S,
CaCI2, HNO2, AI(OH)3, P2O5,
H2CO3, FeS, H3PO4.
2. Закончите уравнения
возможных реакций:
а) Na + H2O =
б) KOH + HNO3 =
в) Сu + HCI =
г) SO2 + H2O =
3. Напишите уравнения
реакций, при помощи которых можно осуществить превращения:
K ---- K2O
---- KOH ---- K3PO4
---- H3PO4
4. Вычислите массу серной кислоты, необходимой для
нейтрализации 250 граммов раствора
гидроксида калия.
другие варианты_решать
Тестовые работы по теме "Важнейшие классы неорганических веществ"
Вариант I
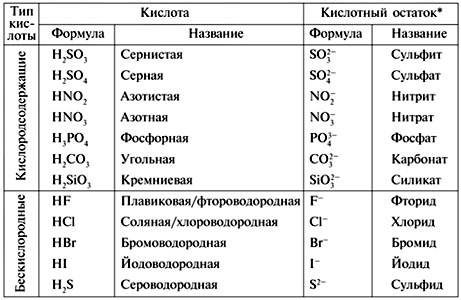
А-1. Формулы только кислот приведены в ряду
1) НСl, NaCl, HNO3
2) H2SO3, H2SO4, H2S
3) Ca(OH)2, H3PO4, Ca3(PO4)2
4) Na2O, NaNO3, HNO3
А-2. Формулы только щелочей приведены в ряду
1) Fe(OH)2, KOH, Ва(ОН)2
2) NaOH, Ca(OH)2, Cu(OH)2
3) KOH, NaOH, LiOH
4) Fe(OH)3, Cu(OH)2, NaOH
A-3. Оксид, который реагирует с гидроксидом натрия, образуя соль,— это
1) Fe2O3
2) К2О
3) SO3
4) BaO
решать дальше






































- Follow Us on Twitter!
- "Join Us on Facebook!
- RSS
Contact