Взаимодействие сахара с кон центрованной серной кислотой
Взаимодействие концентрированной серной кислоты с медью
Таким образом, концентрированная серная кислота взаимодействует с металлами за счет восстановления атомов кислотообразователя.
Качественной реакцией на сульфат-ион SO2-4 является образование белого кристаллического осадка BaSO4, нерастворимого в воде и кислотах:
SO2-4+Ba+2 = BaSO4
Взаимодействие концентрированной серной кислоты с медью
Взаимодействие с металлами
Взаимодействие с металлами идет за счет восстановления ионов водорода.
Концентрированная серная кислота является энергичным окислителем. При нагревании окисляет большинство металлов, в том числе и стоящие в электрохимическом ряду напряжений после водорода, Не реагирует только с платиной и золотом. В зависимости от активности металла в качестве продуктов восстановления могут быть S-2, S° и S+4.На холоду концентрированная серная кислота не взаимодействует с такими сильными металлами, как алюминий, железо, хром. Это объясняется пассивацией металлов. Данную особенность широко используют при ее транспортировке в железной таре.
Однако при нагревании:
Таким образом, концентрированная серная кислота взаимодействует с металлами за счет восстановления атомов кислотообразователя.
Качественной реакцией на сульфат-ион SO2-4 является образование белого кристаллического осадка BaSO4, нерастворимого в воде и кислотах:
SO2-4+Ba+2 = BaSO4








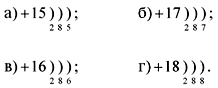


























- Follow Us on Twitter!
- "Join Us on Facebook!
- RSS
Contact