четверг, 29 марта 2012 г.
среда, 28 марта 2012 г.
Строение электронной оболочки атома
Атомная орбиталь - состояние электрона в атоме. Условное обозначение орбитали -  . Каждой орбитали соответствует электронное облако.
. Каждой орбитали соответствует электронное облако.
Орбитали реальных атомов в основном (невозбужденном) состоянии бывают четырех типов:
s, p, d и f.
Электронное облако - часть пространства, в которой электрон можно обнаружить с вероятностью 90 (или более) процентов.
Распределение подуровней по энергиям выражается рядом (в прядке увеличения энергии):






Орбитали реальных атомов в основном (невозбужденном) состоянии бывают четырех типов:
s, p, d и f.
Электронное облако - часть пространства, в которой электрон можно обнаружить с вероятностью 90 (или более) процентов.
Распределение подуровней по энергиям выражается рядом (в прядке увеличения энергии):
1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p ...
Наглядно эта последовательность выражается энергетической диаграммой:

Примеры электронного строения атомов





среда, 21 марта 2012 г.
вторник, 20 марта 2012 г.
Строение и состав атома
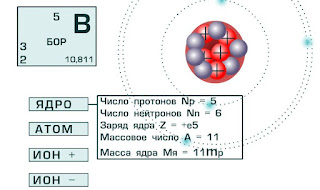
В 1911 г англ. учёный Э. Резерфорд доказал ан опыте, что в центре атома имеется положительно заряженное ядро.
Заряд ядра равен порядковому номеру химического элемента
Из курса физики вам известно, что вокруг положительного ядра находятся отрицательно заряженные частицы электроны - е- . В электронейтральном атоме число электронов должно быть равно заряду ядра и, следовательно, порядковому номеру элемента. Масса электрона очень мала и принимается равной нулю, таким образом, масса атома сосредоточена в ядре, в котором расположены протоны – p+ и нейтроны – n0.
Характеристика нуклонов и электронов
Название частицы
|
Обозначение частицы
|
Электрический заряд
|
Приблизительная масса, а.е.м.
|
|---|---|---|---|
протон
|
p
|
+1
|
1
|
нейтрон
|
n
|
0
|
1
|
электрон
|
e
|
-1
|
1/1840
|
понедельник, 19 марта 2012 г.
воскресенье, 18 марта 2012 г.
среда, 14 марта 2012 г.
вторник, 13 марта 2012 г.
Открытие Периодического закона
Первый вариант
Периодической таблицы элементов был опубликован Дмитрием Ивановичем
Менделеевым в 1869 году - задолго до того, как было изучено строение
атома. В это время Менделеев преподавал химию в Петербургском
университете. Готовясь к лекциям, собирая материал для своего учебника
"Основы химии", Д. И. Менделеев раздумывал над тем, как
систематизировать материал таким образом, чтобы сведения о химических
свойствах элементов не выглядели набором разрозненных фактов.
Ориентиром в этой работе Д. И. Менделееву послужили атомные массы
(атомные веса) элементов. После Всемирного конгресса химиков в 1860
году, в работе которого участвовал и Д. И. Менделеев, проблема
правильного определения атомных весов была постоянно в центре внимания
многих ведущих химиков мира, в том числе и Д. И. Менделеева.
Располагая элементы в порядке возрастания их атомных
весов, Д. И. Менделеев обнаружил фундаментальный закон природы, который
теперь известен как Периодический закон:
Свойства элементов периодически изменяются в соответствии с их атомным весом.
Приведенная формулировка нисколько не противоречит
современной, в которой понятие "атомный вес" заменено понятием "заряд
ядра". Сегодня мы знаем, что атомная масса сосредоточена в основном в
ядре атома. Ядро состоит из протонов и нейтронов. С увеличением числа
протонов, определяющих заряд ядра, растет и число нейтронов в ядрах, а
значит и масса атомов элементов.
До Менделеева было предпринято несколько попыток систематизировать элементы по разным признакам. В основном объединялись сходные
по своим химическим свойствам элементы. Например: Li, Na, K. Или: Cl,
Br, I. Эти и некоторые другие элементы объединялись в так называемые
"триады". Таблица из пяти таких "триад" была опубликована Доберейнером
еще в 1829 году, но она включала лишь небольшую часть из известных к
тому времени элементов.
 В
1864 году англичанин Дж. Ньюлендс заметил, что если располагать
элементы в порядке возрастания их атомного веса, то примерно каждый
восьмой элемент является своего рода повторением первого - подобно тому,
как нота "до" (как и любая другая нота) повторяется в музыкальных
октавах через каждые 7 нот (закон октав). Ниже показан вариант таблицы
Ньюлендса, относящийся к 1865 году. Элементы, имеющие одинаковый атомный
вес (по данным того времени) помещались под одним номером. Можно
видеть, с какими трудностями столкнулся Ньюлендс - наметившиеся
закономерности быстро разрушались, поскольку в его системе не была
учтена возможность существования еще не открытых элементов.
В
1864 году англичанин Дж. Ньюлендс заметил, что если располагать
элементы в порядке возрастания их атомного веса, то примерно каждый
восьмой элемент является своего рода повторением первого - подобно тому,
как нота "до" (как и любая другая нота) повторяется в музыкальных
октавах через каждые 7 нот (закон октав). Ниже показан вариант таблицы
Ньюлендса, относящийся к 1865 году. Элементы, имеющие одинаковый атомный
вес (по данным того времени) помещались под одним номером. Можно
видеть, с какими трудностями столкнулся Ньюлендс - наметившиеся
закономерности быстро разрушались, поскольку в его системе не была
учтена возможность существования еще не открытых элементов.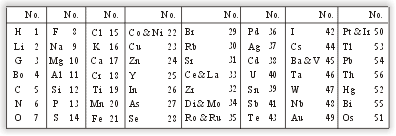 Доклад Ньюлендса «Закон октав и причины химических соотношений среди
атомных весов» обсуждался на заседании Лондонского химического общества 1
марта 1866 года, а краткий отчет о нем публиковался в журнале «Сhemical
News». Ньюлендс был близок к открытию Периодического закона, однако
сама идея последовательной нумерации только известных к тому времени
элементов не просто "ломала" плавное изменение их химических свойств -
эта идея исключала возможность существования еще не открытых элементов,
для которых в системе Ньюлендса просто не было места. Принципиальная
новизна Периодического закона, открытого и сформулированного Д. И.
Менделеевым спустя ровно три года, заключалась в следующем:
Доклад Ньюлендса «Закон октав и причины химических соотношений среди
атомных весов» обсуждался на заседании Лондонского химического общества 1
марта 1866 года, а краткий отчет о нем публиковался в журнале «Сhemical
News». Ньюлендс был близок к открытию Периодического закона, однако
сама идея последовательной нумерации только известных к тому времени
элементов не просто "ломала" плавное изменение их химических свойств -
эта идея исключала возможность существования еще не открытых элементов,
для которых в системе Ньюлендса просто не было места. Принципиальная
новизна Периодического закона, открытого и сформулированного Д. И.
Менделеевым спустя ровно три года, заключалась в следующем:
1. Устанавливалась связь между НЕСХОДНЫМИ по
своим свойствам элементами. Эта связь заключается в том, что свойства
элементов плавно и примерно одинаково изменяются с возрастанием их
атомного веса, а затем эти изменения ПЕРИОДИЧЕСКИ ПОВТОРЯЮТСЯ.
2. В тех случаях, когда создавалось
впечатление, что в последовательности изменения свойств элементов не
хватает какого-нибудь звена, в Периодической таблице предусматривались
ПРОБЕЛЫ, которые надо было заполнить еще не открытыми элементами. Мало
того, Периодический закон позволял ПРЕДСКАЗЫВАТЬ свойства этих
элементов.
Рассказ в стихах об открытии Периодического закона
1
Мир сложен, он полон событий, сомнений
И тайн бесконечных и смелых
загадок
Как чудо природы рождается гений
И в хаосе этом
Находит порядок…
Весь мир большой:
Жара и стужа,
Планет круженье, свет зари-
Всё то, что видим мы снаружи
Законом связано внутри.
Найдётся ль правило простое,
Что целый мир объединит?
Таблицу Менделеев строит
Природы ищет алфавит.
понедельник, 12 марта 2012 г.
Металлы. Экскурс в историю
 Древние люди считали, что именно на звездном
небе - на самом видном месте у нас над головой - запечатлена система
древнейших химических знаний. Небесные светила уходили за горизонт и
снова появлялись. Само погружение их за горизонт как бы говорило об
уходе в землю. И древний человек думал, что его звездный бог
превращается в столь же сияющие земные вещества, что извлекали из
высохших русел или глубоких колодцев. И в сходстве сияния ночных светил и
блеске земных металлов древние нашли божественные связи.
Древние люди считали, что именно на звездном
небе - на самом видном месте у нас над головой - запечатлена система
древнейших химических знаний. Небесные светила уходили за горизонт и
снова появлялись. Само погружение их за горизонт как бы говорило об
уходе в землю. И древний человек думал, что его звездный бог
превращается в столь же сияющие земные вещества, что извлекали из
высохших русел или глубоких колодцев. И в сходстве сияния ночных светил и
блеске земных металлов древние нашли божественные связи.Труднее всего было заметить мерцающий блеск самой быстрой планеты (первой по удаленности от Солнца). Утром или вечером блуждающая звезда, ненадолго загораясь, меркла в легкой дымке светлого небосклона, и поэтому ее олицетворял мифический бог странствия (Гермес, Меркурий). Бога считали покровителем путников, а странствующие купцы превратили его в символ торговли. Поэтически божество представляли по- разному: то бородатым скитальцем с посохом, то юношей в сандалиях с крылышками.
Его же именем стал называться единственный жидкий металл – РТУТЬ.
понедельник, 5 марта 2012 г.
Классификация химических элементов
 Одной из первых попыток систематизации химических элементов была их
классификация, т. е. распределение по классам на основе общих свойств и
признаков. Еще в конце XVIII в. элементы стали делить на две группы —
металлы и неметаллы. Такая классификация была основана на различии
свойств простых веществ.
Одной из первых попыток систематизации химических элементов была их
классификация, т. е. распределение по классам на основе общих свойств и
признаков. Еще в конце XVIII в. элементы стали делить на две группы —
металлы и неметаллы. Такая классификация была основана на различии
свойств простых веществ. Вспомним общие свойства простых веществ металлов и неметаллов.
Металлы хорошо проводят электрический ток и теплоту, имеют характерный
металлический блеск. Многие из них пластичны, т. е. легко
расплющиваются, вытягиваются, поддаются обработке, особенно в нагретом
состоянии. Все металлы (кроме ртути) — твердые кристаллические вещества.
Вспомним общие свойства простых веществ металлов и неметаллов.
Металлы хорошо проводят электрический ток и теплоту, имеют характерный
металлический блеск. Многие из них пластичны, т. е. легко
расплющиваются, вытягиваются, поддаются обработке, особенно в нагретом
состоянии. Все металлы (кроме ртути) — твердые кристаллические вещества.
Неметаллы, как правило, плохие проводники тока, не обладают блеском и
пластичностью. При обычных условиях простые вещества неметаллы могут
быть твердыми (сера, фосфор), жидкими (бром), газообразными (кислород,
азот).
Эти две группы простых веществ существенно различаются и по
химическим свойствам. Металлы взаимодействуют с кислородом и другими
неметаллами, кислотами, солями, но газообразных соединений не образуют.
Неметаллы образуют с водородом летучие соединения; взаимодействуют с
кислородом, часто с образованием газообразных оксидов. С разбавленными
кислотами большинство из них не реагируют.
Как доказать, что оксид, соответствующий металлу, является основным его гидроксид проявляет свойства оснований?
Поместим в пробирку небольшое количество оксида кальция. Добавим к нему воды объемом 2 см3
и хорошо встряхнем. Внесем в полученный раствор 2—3 капли раствора
фенолфталеина и по появлению окраски отметим наличие щелочи в растворе.
Добавив 2 капли раствора соляной кислоты, отметим изменение окраски.
Не все основные оксиды взаимодействуют с водой, однако каждому из
нисоответствует гидроксид, проявляющий свойства основания. Так, оксид
FeOне реагирует с водой, но ему соответствует основание Fe(OH) 2. И оксид, и основание реагируют с кислотами:
FeO + 2HCl = FeCl2 + H2O;
Fe(OH) 2 + 2HCl = FeCl2 + 2H2O.
Кислородные соединения неметаллов обычно являются кислотными оксидами, а их гидроксиды — кислотами.
Fe(OH) 2 + 2HCl = FeCl2 + 2H2O.
Кислородные соединения неметаллов обычно являются кислотными оксидами, а их гидроксиды — кислотами.
Доказательством кислотных свойств этих соединений неметаллов является
их способность вступать в реакции со щелочами с образованием соли и
воды:
CO2 + 2KOH = K2CO3 + H2O;
H3PO4 + 3KOH = K3PO4 + 3H2O.
Кислотные свойства гидроксидов неметаллов легко доказать с помощью индикаторов (лакмуса, метилоранжа или универсального индикатора) по характерной красной окраске.
H3PO4 + 3KOH = K3PO4 + 3H2O.
Кислотные свойства гидроксидов неметаллов легко доказать с помощью индикаторов (лакмуса, метилоранжа или универсального индикатора) по характерной красной окраске.
Однако еще в ХIX в. выяснилось, что оксиды и гидроксиды некоторых
элементов могут проявлять как кислотные, так и основные свойства.
Например, простые вещества таких элементов, как цинк Zn и алюминий Al,
по своим физическим свойствам являются металлами, но их гидроксиды
Zn(OH) 2, Al(OH) 3 проявляют свойства как
оснований, так и кислот, т. е. являются амфотерными соединениями. Слово
«амфотерные» происходит от древнегреческого «амфи» — двойственный. Так,
например, осадок гидроксида алюминия, взаимодействуя с кислотой,
растворяется, т. е. ведет себя как основание. В то же время этот
гидроксид может реагировать и со щелочью, проявляя свойство кислоты.
Смотрите так же статью
Смотрите так же статью
воскресенье, 4 марта 2012 г.
Понятие "Амфотерность"
Амфотерность - способность соединений проявлять либо кислотные либо основные свойства, в зависимости от того с чем они реагируют.
Амфотерных соединений довольно много. Из оксидов двойственными свойствами обладают: оксид цинка, оксид алюминия, оксиды меди, оксиды олова, оксиды свинца, оксид железа (III) и др.
Проверить
Интеллектуальный тренинг “Знаете ли вы…”
1. В 1860 году были известны более 60 химических
элементов, на сегодняшний день открыты более 114
элементов.
2. В организме человека около 70 химических элементов в составе простых и сложных веществ, массовая доля больше всего (кислорода, углерода, азота, кальция).
3.Для изготовления одной лампочки накаливания нужно использовать 7 различных металлов. Какие металлы? ( Fe, W, Ni, Pb, Sn, Sb, Zn). Произнесите их названия.
4. Какой химический элемент называют царем “живой” природы, а какой царем “неживой природы”? (углерод и кремний).
5. Семь металлов создал свет по числу семи планет. Перечислите. Прочитайте латинское название. (Аu, Ag, Cu, Pt, Sn, Hg, Fe). Назовите оксиды этих металлов.
6. Во время 1 мировой войны применение ядовитого желто-зеленого газа привело к смерти многих людей, а благодаря посуде, из которого ели пищу офицеры армии Македонского избежали кишечные болезни. Назовите химические элементы, входящие в состав данных веществ (хлор, серебро).
7. Причиной гибели экспедиции А.Шмидта на Северном полюсе была “оловянная чума”. Что произошло с оловом, из которого были канистры, содержащие продукты питания, воду. (При низких температурах олово крошится – переходит в аморфное состояние аллотропного видоизменения).
2. В организме человека около 70 химических элементов в составе простых и сложных веществ, массовая доля больше всего (кислорода, углерода, азота, кальция).
3.Для изготовления одной лампочки накаливания нужно использовать 7 различных металлов. Какие металлы? ( Fe, W, Ni, Pb, Sn, Sb, Zn). Произнесите их названия.
4. Какой химический элемент называют царем “живой” природы, а какой царем “неживой природы”? (углерод и кремний).
5. Семь металлов создал свет по числу семи планет. Перечислите. Прочитайте латинское название. (Аu, Ag, Cu, Pt, Sn, Hg, Fe). Назовите оксиды этих металлов.
6. Во время 1 мировой войны применение ядовитого желто-зеленого газа привело к смерти многих людей, а благодаря посуде, из которого ели пищу офицеры армии Македонского избежали кишечные болезни. Назовите химические элементы, входящие в состав данных веществ (хлор, серебро).
7. Причиной гибели экспедиции А.Шмидта на Северном полюсе была “оловянная чума”. Что произошло с оловом, из которого были канистры, содержащие продукты питания, воду. (При низких температурах олово крошится – переходит в аморфное состояние аллотропного видоизменения).
суббота, 3 марта 2012 г.
Викторина "Удивительный мир кислот"
- Первая кислота, с которой познакомился человек.
- Фамилия известного шведского ученого, впервые давшего в 1887 году определение кислот с точки зрения теории электролитической диссоциации.
- «Лунная» кислота, полученная в 1827 году немецким химиком Э.Мичерлихом.
- «Сахарная» кислота, полученная в 1884 году К.В.Шееле.
- «Горючая» кислота, свойства которой изучал русский химик Т.Ловиц в 1793 году.
- Кислота, полученная в 1963 году, но сила которой экспериментально до сих пор не определена.
- Кислота, которая «ест» стекло.
- Кислотно – основный индикатор, который впервые получил из лишайника Роберт Бойль.
- Ее второе название – соляная.
- Кислородсодержащая кислота, сильное водоотнимающее средство.
- Она приятного вкуса и ее используют для приготовления напитков, мармелада, пастилы.
- Попав под грозовой дождь, можно «искупаться» в этой кислоте.
- Она образуется в мышцах при интенсивной работе.
- Она слабая, но является сильным ядом; содержится в ядрышках слив, вишен, семенах яблок и черемухи.
- Ее используют для изготовления сухих супов, киселей, так как она способна обволакивать частички и не давать им склеиваться друг с другом.
- Она является пластификатором, поэтому применяется для приготовления лака для ногтей, лака для волос.
- Она – отличный консервант, в большом количестве содержится в клюкве и бруснике, поэтому они могут очень долго храниться без дополнительных условий.
- Она является природным витамином С.
- Ее содержат помидоры.
- Мухоморы содержат эту кислоту; лоси, поедая мухоморы, излечиваются от внутренних паразитов.

пятница, 2 марта 2012 г.
Из материалов журнала "1 сентября. Химия"
Предлагаю познакомиться с заданиями из журнала:
1. Решить цепочки превращений
а) Цепочки превращений. Сера
б) Цепочки превращений. Галогены
2. Интерактивная развивающая игра "Самый умный химик"
1. Решить цепочки превращений
а) Цепочки превращений. Сера
б) Цепочки превращений. Галогены
2. Интерактивная развивающая игра "Самый умный химик"
Подписаться на:
Сообщения (Atom)








































- Follow Us on Twitter!
- "Join Us on Facebook!
- RSS
Contact