вторник, 24 апреля 2012 г.
Примерные задания ЕГЭ по пройденным темам.
Скачать бланк ответов №1
ЕГЭ 2012
Часть 1
При
выполнении заданий этой части в бланке ответов № 1 под номером выполняемого
вами задания (А1–А12) поставьте знак « × » в клеточку, номер которой
соответствует номеру выбранного вами ответа.
A1 Одинаковое число электронов содержат частицы
1) Al3+ и N3–
2) Ca2+ и Cl+5
3) S0 и Cl–
4) N3– и Р3–
A1 Одинаковое число электронов содержат частицы
1) Al3+ и N3–
2) Ca2+ и Cl+5
3) S0 и Cl–
4) N3– и Р3–
A2 В ряду элементов
Na → Mg → Al → Si
1)
уменьшаются радиусы атомов
2) уменьшается число протонов в ядрах атомов
3) увеличивается число электронных слоёв в атомах
4) уменьшается высшая степень окисления атомов
2) уменьшается число протонов в ядрах атомов
3) увеличивается число электронных слоёв в атомах
4) уменьшается высшая степень окисления атомов
A3 Верны ли следующие суждения о
соединениях металлов?
А. Степень окисления бериллия в высшем оксиде равна +2.
Б. Оснóвные свойства оксида магния выражены сильнее, чем у оксида алюминия.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
А. Степень окисления бериллия в высшем оксиде равна +2.
Б. Оснóвные свойства оксида магния выражены сильнее, чем у оксида алюминия.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
A4 Химическая связь в молекулах метана
и хлорида кальция соответственно
1) ковалентная полярная и металлическая
2) ионная и ковалентная полярная
3) ковалентная неполярная и ионная
4) ковалентная полярная и ионная
1) ковалентная полярная и металлическая
2) ионная и ковалентная полярная
3) ковалентная неполярная и ионная
4) ковалентная полярная и ионная
A5 Степень окисления хлора равна +7 в
соединении
1) Ca(ClO3)2
2) HClO3
3) NH4Cl
4) HClO4
1) Ca(ClO3)2
2) HClO3
3) NH4Cl
4) HClO4
КОНТРОЛЬНАЯ РАБОТА «СТРОЕНИЕ АТОМА. ХИМИЧЕСКАЯ СВЯЗЬ»
ВАРИАНТ №1
1. Дать характеристику элементам по положению в периодической системе по плану: название, химический знак, относительная атомная масса, порядковый номер, номер периода, большой или малый, номер группы, главная или побочная подгруппа. Строение атома: заряд ядра, число электронов вокруг ядра, число протонов, нейтронов в ядре, распределение электронов по энергетическим уровням. Металл или неметалл. Формула высшего оксида. Формула летучего водородного соединения (для неметаллов).
Элементы: а) литий, б) S.
2. Расположите химические элементы в порядке возрастания: а) металлических свойств – Ba, Mg, Ca; б) неметаллических свойств – C, F ,O. Объясните с точки зрения строения атома.
3. Определить вид химической связи (ионная, металлическая, ковалентная полярная или неполярная). Записать схемы образования данных видов связей для следующих веществ: F2, SiH4, NaCl, Al. другие варианты см здесь |
суббота, 21 апреля 2012 г.
пятница, 20 апреля 2012 г.
четверг, 19 апреля 2012 г.
среда, 18 апреля 2012 г.
понедельник, 16 апреля 2012 г.
воскресенье, 15 апреля 2012 г.
Основыне понятия темы "Химическое строение вещества"
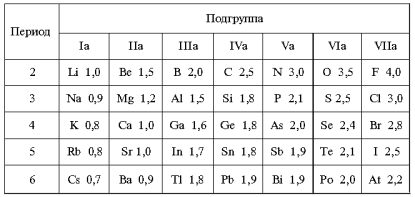
Электроотрицательность — химическое свойство атома, количественная
характеристика способности атома в молекуле притягивать к себе электроны от
атомов других элементов.
Химическая связь - это взаимодействие двух
атомов, осуществляемое путем обмена электронами. При образовании химической
связи атомы стремятся приобрести устойчивую восьмиэлектронную (или
двухэлектронную) внешнюю оболочку, соответствующую строению атома ближайшего
инертного газа. Различают следующие виды химической связи: ковалентная (полярная и неполярная;
обменная и донорно-акцепторная), ионная, водородная и металлическая.
Ковалентная связь - "совместное участие" ( в слове "ковалентная"
приставка "ко-" означает " А "валента" в переводе на
русский – сила, способность.) - способность
атомов связываться с другими атомами.
При образовании ковалентной связи атомы объединяют свои электроны как бы в общую "копилку" – молекулярную орбиталь, которая формируется из атомных оболочек отдельных атомов. Эта новая оболочка содержит по возможности завершенное число электронов и заменяет атомам их собственные незавершенные атомные оболочки.
Ионной связью - это химическая связь, образованная за счет электростатического притяжения между катионами и анионами.
Металлическая связь— связь между положительными ионами в кристаллах металлов, осуществляемая за счет притяжения электронов, свободно перемещающихся по кристаллу
Валентность определяется числом химических связей, которые атом данного
элемента может образовать с атомами других элементов. В образовании
химических связей участвуют электроны внешнего электронного уровня.
Валентность можно определить также как число электронов, которые атом
данного химического элемента может предоставить для образования
химических связей с атомами других элементов.
суббота, 14 апреля 2012 г.
пятница, 13 апреля 2012 г.
Домашнее задание на 16 апреля.
Открыв модуль по теме "Электроотрицательность", заполнить ответы и загрузить файл через "Обратную связь"
четверг, 12 апреля 2012 г.
понедельник, 9 апреля 2012 г.
Самостоятельная работа по теме "Периодический закон "
Вариант I
1. В ряду Si
1) усиливаются
2) ослабевают
3) не изменяются
4) изменяются периодически
2. В ряду Mg
1) усиливаются
2) ослабевают
3) не изменяются
4) изменяются периодически
3. В ряду оксидов MgO
1) усиливаются
2) ослабевают
3) не изменяются
4) сначала усиливаются, затем ослабевают
4. В ряду H2SiO3
5. Наиболее ярко выражены неметаллические свойства у простого вещества, образованного атомами, которые имеют строение электронной оболочки
1) 2, 8, 4
2) 2, 8, 5
3) 2, 8, 6
4) 2, 8, 7
6. Наиболее ярко выражены неметаллические свойства у простого вещества, образованного атомами, которые имеют строение электронной оболочки
1) 2, 7
2) 2, 8, 7
3) 2, 8, 8, 7
4) 2, 8, 6
7. Усиление металлических свойств элементов, расположенных в А-группах периодической системы, с увеличением порядкового номера обусловлено
1) увеличением атомной массы элемента
2) увеличением общего числа электронов
3) увеличением атомного радиуса элемента
4) увеличением номера периода
8. Формула летучего водородного соединения химического элемента H3R. Группа химических элементов периодической системы Д. И. Менделеева, к которой принадлежит этот элемент
1) III
2) V
3) VII
4) IV
9. Установите соответствие между массовым числом химического элемента и числом нейтронов в ядре атома этого элемента.
| 1) 56 2) 19 3) 31 4) 24 |
А. 10 Б. 16 В. 30 Г. 14 Д. 12 |
| 1 | 2 | 3 | 4 |
1) 2, 2
2) 2, 1
3) 2, 8, 7
4) 2, 8, 8, 1
Ответ: ________________________
11. Установите соответствие между ионом и его электронным строением.

| 1 | 2 | 3 | 4 |
Вопросы для обсуждения по теме "Периодический закон и периаодическая система Д.И. Менделеева в свете строения атома.
- Характеристика элементарных частиц, входящих в состав атома.
- Понятие об изотопах. Химический элемент.
- Расположение электронов в атоме. Понятие об энергетическом уровне. Правила заполнения энергетических уровней атома электронами.
- Составление схем строения атома и электронных формул элементов 1—3-го периодов периодической таблицы.
- Периодический закон Д. И. Менделеева (современная формулировка). Периодическая таблица химических элементов.
- Изменение в периодах и главных подгруппах (А-группах) свойств химических элементов, а также их соединений: заряда ядра, радиуса атома, числа электронов на внешнем уровне, металлических и неметаллических свойств, основных и кислотных свойств. Причины периодического изменения свойств.
- Характеристика химических элементов по их положению в периодической таблице.
- Научно-практическое значение периодического закона.
Значение периодического закона
Используя Периодический закон, Д.И. Менделеев стал первым исследователем, сумевшим решить проблемы прогнозирования в химии. Это проявилось уже через несколько лет после создания Периодической системы элементов, когда были открыты предсказанные Менделеевым новые химические элементы. Периодический закон помог также уточнить многие особенности химического поведения уже открытых элементов. Успехи атомной физики, включая ядерную энергетику и синтез искусственных элементов, стали возможными лишь благодаря Периодическому закону. В свою очередь, они расширили и углубили сущность закона Менделеева, расширили пределы Периодической системы элементов.
Периодический закон является универсальным законом. Он относится к числу таких общих научных закономерностей, которые реально существуют в природе и поэтому в процессе эволюции наших знаний никогда не потеряют своего значения. Установлено, что периодичности подчиняются не только электронное строение атома, но и тонкая структура атомных ядер, что говорит о периодическом характере свойств в мире элементарных частиц.
Со временем роль Периодического закона не уменьшается. Он стал важнейшей основой неорганической химией. Он используется, например, при синтезе веществ с заранее заданными свойствами, создании новых материалов, подборе эффективных катализаторов.
Неоценимо значение Периодического закона в преподавании общей и неорганической химии. Его открытие было связано с созданием учебника по химии, когда Менделеев пытался предельно четко изложить сведения об известных на тот момент 63 химических элементах. Сейчас число элементов увеличилось почти вдвое, и Периодический закон позволяет выявлять сходство и закономерности свойств различных химических элементов с использованием их положения в Периодической системе.
Периодический закон является универсальным законом. Он относится к числу таких общих научных закономерностей, которые реально существуют в природе и поэтому в процессе эволюции наших знаний никогда не потеряют своего значения. Установлено, что периодичности подчиняются не только электронное строение атома, но и тонкая структура атомных ядер, что говорит о периодическом характере свойств в мире элементарных частиц.
Со временем роль Периодического закона не уменьшается. Он стал важнейшей основой неорганической химией. Он используется, например, при синтезе веществ с заранее заданными свойствами, создании новых материалов, подборе эффективных катализаторов.
Неоценимо значение Периодического закона в преподавании общей и неорганической химии. Его открытие было связано с созданием учебника по химии, когда Менделеев пытался предельно четко изложить сведения об известных на тот момент 63 химических элементах. Сейчас число элементов увеличилось почти вдвое, и Периодический закон позволяет выявлять сходство и закономерности свойств различных химических элементов с использованием их положения в Периодической системе.
четверг, 5 апреля 2012 г.
Подписаться на:
Сообщения (Atom)

























- Follow Us on Twitter!
- "Join Us on Facebook!
- RSS
Contact